Ob Waschmittel, Wimperntusche oder Weihnachtsschokolade – viele Alltagsprodukte enthalten Fettsäuren aus Palmöl oder Kokosnussöl. Die Gewinnung dieser Rohstoffe geht jedoch mit massiven Umweltproblemen einher: Regenwälder werden gerodet, Lebensräume gefährdeter Tierarten vernichtet und traditionellen Landwirten die Lebensgrundlage entzogen. Das Team um Prof. Martin Grininger von der Goethe-Universität Frankfurt hat nun einen biotechnologischen Ansatz entwickelt, der eine umweltfreundlichere Produktion ermöglichen könnte.
Ein molekulares Fließband mit präziser Kontrolle
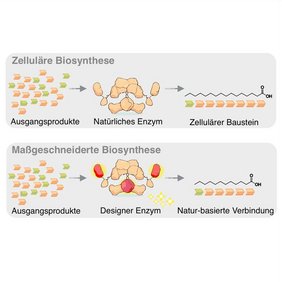
Im Zentrum der Arbeiten steht ein Enzym namens Fettsäuresynthase (engl. Fatty Acid Synthase, FAS) – eine Art molekulares Fließband, das in allen Lebewesen Fettsäuren aufbaut. „In dieser Funktion ist die FAS eines der wichtigsten Enzyme des Stoffwechsels einer Zelle und wurde für diese Aufgabe über viele Millionen Jahre optimiert“, erklärt Grininger.
Das Enzym produziert normalerweise Palmitinsäure, eine Fettsäure mit 16 Kohlenstoffatomen, die als Baustein für Zellmembranen und Energiespeicher dient. Die Industrie benötigt jedoch vor allem kürzere Varianten mit 6 bis 14 Kohlenstoffatomen – genau die, die derzeit aus den problematischen Pflanzenölen gewonnen werden. Der entscheidende Vorteil der neuen Methode: „Grundsätzlich liegt unser Vorteil in der sehr präzisen Kontrolle der Kettenlänge. Wir können theoretisch jede Kettenlänge machen und zeigen das am Beispiel der C12 Fettsäure, die man ansonsten nur aus Palmkernen oder Kokosnuss bekommt“, so Grininger.
Verständnis durch Veränderung
Grininger und sein Team haben in den letzten 20 Jahren maßgeblich dazu beigetragen, die molekularen Grundlagen der FAS zu verstehen. Sie fanden heraus, dass die Kettenlänge durch das Zusammenspiel zweier Untereinheiten gesteuert wird: Die Ketosynthase verlängert die Kette wiederholt um zwei Kohlenstoffatome, während die Thioesterase die fertige Kette als Fettsäure abspaltet. „Wir haben uns dann gefragt, ob wir über die Analyse hinausgehen und FAS mit neuer Kettenlängenregulation bauen können“, sagt Grininger. „Wahres Verständnis fängt dann an, wenn man ein Phänomen verändern oder maßschneidern kann.“
Zwei gezielte Eingriffe führen zum Erfolg
Sein Doktorand Damian Ludig griff dieses Konzept auf: „Was können wir erreichen, wenn wir gezielt in das Zusammenspiel der beiden Untereinheiten eingreifen – das war die grundlegende Frage, die wir uns am Beginn meiner Doktorarbeit gestellt haben“, erzählt Ludig. „Und können wir dadurch kontrollieren, mit welcher Kettenlänge die Fettsäuren hergestellt werden?“
Ludig nutzte die Methode des sogenannten Proteinengineerings, bei der einzelne Aminosäuren ausgetauscht oder ganze Proteinbereiche modifiziert werden können. „Zwei Änderungen der FAS mittels Proteinengineering haben schließlich zum Ziel geführt“, sagt Ludig. „In der Ketosynthase-Untereinheit habe ich zunächst eine Aminosäure ausgetauscht, was dazu führte, dass Ketten ab einer bestimmten Länge nur mit geringer Effizienz weiter verlängert werden. Zusätzlich habe ich die Untereinheit Thioesterase gegen ein ähnliches Protein aus Bakterien getauscht, das Aktivität in der Abspaltung kurzer Kettenlängen zeigt.“ Je nach weiterer Justierung konnte Ludig so Fettsäuren kurzer und mittlerer Länge herstellen.
Von Frankfurt nach Dalian
Die Zusammenarbeit mit der Arbeitsgruppe von Prof. Yongjin Zhou vom Dalian Institut für Chemische Physik der Chinesischen Akademie der Wissenschaften brachte schließlich den Durchbruch. Unterstützt von der Deutschen Forschungsgemeinschaft (DFG) und der chinesischen National Natural Science Foundation (NSFC) gelang es Zhou und seinem Labor, Hefestämme zu entwickeln, die Fettsäuren mit nur 12 statt 16 Kohlenstoffatomen produzieren. Verschiedene Designer-FAS aus dem Grininger-Labor wurden dafür in die Hefen integriert und optimiert.
Beide Labore haben ihre Technologien bereits zum Patent angemeldet. „Von chinesischer Seite war die Firma Unilever am Projekt beteiligt. Unsere Entwicklung hat bislang ohne Industriebeteiligung stattgefunden, jedoch streben wir eine Zusammenarbeit mit einem Industriepartner an, um die Technologie in die Anwendung zu bringen“, so Grininger.
Weitergedacht: Von Fettsäuren zu Arzneistoffen
In einem zweiten Projekt ging das Labor noch einen Schritt weiter. Felix Lehmann untersuchte in seiner Doktorarbeit, wie universell FAS für maßgeschneiderte Biosynthesen einsetzbar sind. „Diese Frage ist auch von der Notwendigkeit angetrieben, chemische Verfahren immer weiter in Richtung nachhaltiger und grüner Chemie zu entwickeln“, erklärt Grininger.
Die konkrete Fragestellung: Können FAS Styrylpyrone herstellen? Diese Moleküle sind Vorläufer von Substanzen aus der Kava-Pflanze, die als potenziell angstlösende Wirkstoffe medizinisches Interesse wecken. Auch hier gelang Lehmann der Erfolg mit relativ wenigen Änderungen: „Zunächst haben wir den Teil der FAS weggeschnitten, den wir für die angestrebten Produkte nicht brauchen. Anschließend haben wir die Untereinheit Ketosynthase verändert, damit Zimtsäure als Startmolekül genutzt werden kann“, erklärt er. Das Team integrierte sogar ein weiteres Protein in die Struktur der FAS, sodass es Teil des Multienzyms wurde.
„Wir haben in diesem Projekt schließlich noch sehr systematisch betrachtet, wie wir die gesamte Biosynthese ausgehend von leicht verfügbaren Bausteinen realisieren können“, führt Grininger aus. Die Erkenntnisse seien zwar nicht von unmittelbarer Anwendungsrelevanz, helfen aber das Design neuer Synthasen anzuleiten.
An der Schnittstelle von Chemie und Biologie
„Wir haben uns als Labor in den letzten Jahren sehr gut in Richtung Biokatalyse und biotechnologische Anwendungen entwickelt – mit vielen wichtigen Beiträgen aus zahlreichen Projekten von Mitarbeiter*innen und Student*innen. Diesen Weg werden wir weitergehen. Im Rahmen des Exzellenzclusters SCALE werden wir mithilfe dieses Enzyms außerdem maßgeschneiderte Biomembranen erzeugen. Ihre Analyse hilft dabei, zentrale Zellbestandteile wie das endoplasmatische Retikulum oder die Mitochondrien besser zu verstehen“, resümiert Grininger.
Ob die Technologie die Palmöl-Problematik tatsächlich entschärfen kann, hängt nun von der erfolgreichen Skalierung mit Industriepartnern ab. Die wissenschaftliche Grundlage ist jedenfalls gelegt – und das Labor hat noch viele Ideen.
Goethe-Universität Frankfurt
Originalpublikationen:
Damian L. Ludig, Xiaoxin Zhai, Alexander Rittner, Christian Gusenda, Maximilian Heinz, Svenja Berlage, Ning Gao, Adrian J. Jervis, Yongjin J. Zhou & Martin Grininger. Engineering metazoan fatty acid synthase to control chain length applied in yeast. Nature Chemical Biology (2026) https://doi.org/10.1038/s41589-025-02105-w
Felix Lehmann, Nadja Joachim, Carolin Parthun, Martin Grininger. Design of a Multienzyme Derived from Mouse Fatty Acid Synthase for the Compartmentalized Production of 2-Pyrone Polyketides. Angewandte Chemie International Edition (2025). https://doi.org/10.1002/anie.202511726