Eine vielversprechende biologische Lösung, um den hohen CO₂-Gehalt in der Atmosphäre zu verringern, ist das Recycling von Kohlenstoff mit Hilfe acetogener Bakterien. Diese Mikroorganismen können CO₂ in großen Industrieanlagen fixieren – und daraus Bio-Kraftstoffe und recycelte Kohlenstoffverbindungen produzieren. Ihr Stoffwechsel ist jedoch noch ein großes Rätsel, an dessen Erforschung Schuller arbeitet.
Die verschiedenen – nicht unbedingt miteinander verwandten, aber immer ohne Sauerstoff lebenden – acetogenen Bakterien nutzen einen speziellen Stoffwechselweg. Sie stellen Acetat (Essigsäure-Salz) her, das sie zur Atmung verwenden, wie andere Lebewesen Sauerstoff. Vermutlich ist dies der älteste biochemische Stoffwechselweg auf der Erde: Aus CO₂ und Wasserstoff, die bereits auf der frühen Erde vorhanden waren, bilden die Bakterien organische Verbindungen, also „lebende Materie“.
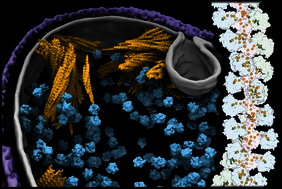
Schullers Gruppe hat begonnen, die einzelnen enzymatischen Schritte, die dafür notwendig sind, aufzuklären. Dabei charakterisierten sie bislang unbekannte Mechanismen der Enzyme und ihre Rolle im Stoffwechsel der Bakterien. Eins dieser Enzyme kann Wasserstoff direkt zur Reduktion von CO₂ nutzen: Diese Wasserstoff-abhängige CO₂-Reduktase (HDCR) ist 10.000 Mal effizienter als jeder chemische Katalysator – und damit ein Spitzenkandidat für die biotechnologische Forschung. Um die molekulare Grundlage dieses Enzyms zu verstehen, untersuchte es Schullers Gruppe mit Hilfe der Kryo-Elektronenmikroskopie. Sie enthüllten eine überraschende Struktur: Das Enzym bildet „Nano-Drähte“, auf denen die enzymatischen Untereinheiten angeordnet sind. Diese ungewöhnliche Architektur erklärt die herausragenden katalytischen Eigenschaften. Je länger der „Draht“ ist, desto höher seine Aktivität. Mutations-Experimente zeigen, dass lange Strukturen die katalytische Aktivität des Enzyms maximieren.
Zelluläre Elektronentomografie lieferte Einblicke in die natürliche Umgebung der Drähte: An der Spitze der Zellen sitzen große ringförmige Strukturen aus verflochtenen „Drähten“. „Wir vermuten, dass diese Organisation eine Anpassung an extreme Umweltbedingungen ist“, erklärt Schuller. Sie gewährleiste eine große Oberfläche mit vielen untereinander verknüpften Reaktionszentren für die Oxidation von Wasserstoff. Damit sind stets ausreichend Elektronen vorhanden, um das in die Zelle diffundierende CO₂ einzufangen und zu konzentrieren. Die HDCR ermöglicht also einen acetogenen Kohlenstoff-Konzentrierungsmechanismus, der nötig ist, um unter harschen Bedingungen zu überleben.
Wichtig für diese Studien ist spezielles Handwerkszeug: So gewährleistet ein Schutzgaszelt Sauerstoff-freie Bedingungen für die elektronenmikroskopische Probenvorbereitung. „Der Lebensstil solcher Mikroorganismen und ihre Enzyme halten noch viele Geheimnisse bereit“, verspricht Schuller. „Mit unserer Forschung wollen wir zur Lösung gesellschaftlicher Probleme wie dem menschgemachten Klimawandel beitragen, indem wir den Weg für die Nutzung von CO₂ als Rohstoff für wertvolle Produkte ebnen“. Entsprechend optimierte Mikroben und neuartige synthetische Stoffwechselwege könnten CO₂-Emissionen reduzieren und eine nachhaltigere Produktion ermöglichen, die CO₂ in den Ressourcenkreislauf einbindet.
Die VAAM hebt neben Schullers imponierender Publikationsliste sein breites Methodenspektrum hervor: Strukturbiologie, Kryo-Elektronenmikroskopie, Einzelpartikel-Analyse, Modellierung, biochemische und zellbiologische Grundlagen für anaerobe Untersuchungen. „Schuller klärte auf, warum HDCR alle bis heute entwickelten chemischen Katalysatoren übertrifft“, lobt die Jury. Seine Expertise wurde letztes Jahr mit dem hochdotierten Starting Grant Two-CO₂-One der Europäischen Forschungskommission (ERC) belohnt. Für VAAM-Präsident Franz Narberhaus ist Schuller ein beispielhaft engagierter Forscher: „Er brennt für die Wissenschaft – und zeigt Mut und Bereitschaft, immer wieder neue wissenschaftliche Gebiete und Techniken zu erschließen“.
Dr. Jan Michael Schuller (36) ist Emmy-Noether Nachwuchsgruppenleiter am SYNMIKRO-Forschungszentrum und dem Chemie-Department der Universität Marburg. Er studierte Biochemie an der Universität Tübingen und promovierte 2016 bei Prof. Dr. Wolfgang Baumeister an der TU München. Es folgte ein Postdoc bei Prof. Dr. Elena Conti am Max-Planck-Institut für Biochemie in Martinsried. Schuller erhielt 2021 den Heinz Maier-Leibnitz-Preis der DFG und 2022 einen ERC Starting Grant für sein Projekt Two-CO₂-One.
Informationen: https://www.schullerlab.org/