Nur ein Tausendstel Milligramm des bakteriellen Botulinumtoxins ist nötig, um einen lebenden Organismus zu töten. Das Toxin entfaltet seine tödliche Wirkung, indem es die Freisetzung von Neurotransmittern an der Verbindungsstelle von Nervenzellen und Muskeln verhindert und diese dadurch lähmt. So simpel dieser Vorgang auch erscheinen mag, handelt es sich hierbei jedoch um einen ausgeklügelten, mehrstufigen Prozess. Nicht weniger komplex und auch sehr wirkungsvoll ist der Vergiftungsprozess von Toxinkomplexen (Tc), den Virulenzfaktoren vieler insekten- und humanpathogener Bakterien.
Eine bakterielle Spritze injiziert ein tödliches Enzym
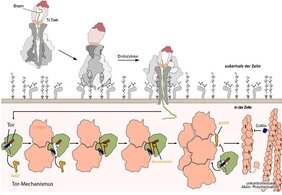
Der Wirkmechanismus der Tc-Toxine ist erst in jüngster Zeit durch die strukturbiologischen Arbeiten der Arbeitsgruppe um Stefan Raunser am MPI Dortmund näher aufgeklärt worden. "Mittels Kryo-Elektronenmikroskopie konnten wir die Struktur der Tc-Toxin-Untereinheiten aufklären und zeigen, wie sich diese zusammensetzen. So konnten wir erstmals die Schlüsselschritte der Toxin-Aktivierung und der Membranpenetration verstehen", sagt Raunser. Die Forschenden konnten zeigen, dass die Untereinheiten des Tc-Toxin-Komplexes zusammen wie eine Spritze funktionieren (Link zur früheren Pressemitteilung): Sobald sich die Untereinheiten zusammensetzen, lösen strukturelle Veränderungen im Komplex die Öffnung eines Kokons aus, der ein giftiges Enzym enthält. In einem einzigartigen Injektionsmechanismus wird das Enzym über einen Kanal in die Wirtszelle geschleust (Link). Dort entfaltet es seine tödliche Wirkung, indem es die Regulierung des Zytoskeletts der Zelle stört, ein Netzwerk von polymerisierten Aktinfilamenten (F-Aktin) mit vielen wichtigen zellulären Aufgaben.
Toxin legt sich seinen Gegner zurecht und bringt ihn so in Schlagdistanz
"Lange Zeit ist uns ein vollständiges Bild des Vergiftungsprozesses verwehrt geblieben, da uns die Strukturdaten der injizierten Enzyme, zu denen auch TccC3 gehört, fehlten," sagt Raunser. Über TccC3 war bis vor kurzem nur bekannt, dass es eine ADP-Ribose-Gruppe auf Aktin überträgt und so dessen abnormale Polymerisation fördert, was wiederum die Aktinfilamente verklumpen lässt. "TccC3 ist aufgrund seiner Größe und hohen Flexibilität das, was wir ein "kompliziertes" System für Strukturuntersuchungen nennen", sagt Hartmut Oschkinat. "Nur durch den Einsatz von Protein-NMR in Lösung konnten wir diese Herausforderung meistern und erstmals die 3D-Struktur des Proteins sichtbar machen". Durch die Zusammenführung zweier weiterer Kryo-EM-Aufnahmen von F-Aktin gebunden an TccC3 und vom modifizierten F-Aktin allein haben die Forschenden den einzigartigen Wirkmechanismus des Enzyms aufgedeckt. "TccC3 agiert wie ein Boxer, der sich seinem Gegner gegenüber so positioniert, dass dieser angreifbar wird", sagt Stefan Raunser. Im ersten Schritt bindet das Enzym an eine Region zwischen zwei aufeinanderfolgenden Aktin-Untereinheiten des F-Aktins. TccC3 öffnet dann ein Tor, sodass die im Molekül NAD+ enthaltene ADP-Ribose-Gruppe in Schlagdistanz zu einer reaktiven Stelle im Aktin gebracht werden kann. Sobald die sperrige ADP-Ribose-Gruppe auf das F-Aktin übertragen wurde, ist es für depolymerisierende Faktoren nicht mehr zugänglich, wodurch F-Aktin nicht mehr abgebaut werden kann und verklumpt.
Neben dieser Entdeckung haben die Wissenschaftler mit ihren Erkenntnissen auch eine Erklärung für die auffallend hohe Effizienz des Enzyms gefunden. Wenn sich das Enzym vom F-Aktin ablöst, verhindert sein Tor-Mechanismus eine Rückbindung an das bereits veränderte Aktin und so wird das Enzym für den nächsten Angriff vorbereitet. "Es ist erstaunlich, wie sich all diese Mechanismen entwickelt haben, um die Wirksamkeit des Giftes maximal zu steigern. Und die Natur hat ganze Arbeit geleistet, denn Botulinumtoxine, Ricin und andere Biotoxine gelten immer noch als die giftigsten Substanzen, die man kennt", fasst Raunser abschließend zusammen.
(Max-Planck-Institut für molekulare Physiologie)
Originalpublikation:
Belyy A, Lindemann F, Roderer D, Funk J, Bardiaux B, Protze J, Bieling P, Oschkinat H, Raunser S (2022). Mechanism of threonine ADP-ribosylation of F-actin by a Tc toxin. Nat Commun. DOI: 10.1038/s41467-022-31836-w