In den ersten Stunden des Lebens durchlaufen alle Tiere einen faszinierenden Prozess. Bei Befruchtung vereinigen sich zwei hoch spezialisierte Zellen, die Eizelle und das Spermium, um einen völlig neuen Organismus mit eigenem Genom zu schaffen. Interessanterweise ist die Transkription des neuen zygotischen Genoms zunächst stillgelegt. Die Zygote kann Stunden oder manchmal Tage nach der Befruchtung keine eigene RNA und Proteine produzieren und überlebt nur, indem sie sich auf RNA und Eiweiße der Mutter verlässt, die zuvor in der Eizelle eingelagert wurden.
Diese hinterlegten Eiweiße und Moleküle der Mutter sind auch für die „Vorbereitung“ bzw. Reogranisation des zygotischen Genoms verantwortlich, damit es später aktiviert werden und seine eigene RNA und Eiweiße produzieren kann. „Nach der Befruchtung muss das Chromatin, also die Verpackung des Genoms, in einen sozusagen naiven Zustand umgebaut werden. Nur so kann der noch einzellige Embryo später die verschiedenen Zelllinien hervorbringen, aus denen sich schließlich all die unterschiedlichen Zelltypen des Organismus entwickeln. Die Umgestaltung des Chromatins, um alles für die Übernahme der Kontrolle durch die Zygote vorzubereiten, findet während dieser sehr frühen Phase der Entwicklung statt, in der das Genom noch keine eigenen Gene exprimiert“, erklärt Nicola Iovino, Gruppenleiter am Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg.
Das Embryo übernimmt die Kontrolle
Dieser Prozess in der Embryonalentwicklung, bei der die Kontrolle über die Entwicklung von den in der Eizelle gespeicherten, mütterlichen Genmaterialien auf das neu entstanden Genom der Zygote übergeht, wird als zygotische Genomaktivierung (engl. zygotic genome activation, ZGA) bezeichnet und bedeutet auch das gleichzeitige Aktiviere von Tausenden von Genen.
Das Labor von Nicola Iovino will am Beispiel der Fruchtfliege Drosophila melanogaster verstehen, wie das zygotische Genom und Epigenom geformt wird, um in der frühen Entwicklung die eigene Transkription, also die eigene Produktion von RNA und Eiweißen, zu starten. „Spezifische Proteine, die als sogenannte Pionier-Transkriptionsfaktoren bezeichnet werden, sind hierbei entscheidend. Bei der Fruchtfliege ist ein Pionierfaktor namens Zelda bekannt. Aus früheren Studien wissen wir, der die Genomaktivierung koordiniert. Fehlt Zelda, wird die Entwicklung gestoppt und die Embryonen sterben kurz vor der ZGA. Allerdings reguliert Zelda nur etwa zehn Prozent der Gene im frühen Embryo. Und dies veranlasste uns danach zu fragen, welche anderen Mechanismen es geben muss, um den der Rest der Gene zu regulieren,“ erklärt Dafne Ibarra Morales, Erstautorin der neuen Publikation.
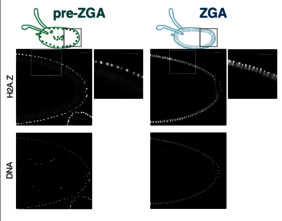
H2A.Z als wichtiger Regulator für die Aktivierung der Zygote
In ihrer neuesten Studie zeigt das Team, dass auch noch ein anderes Enzym namens Domino für die Formung des Chromatins in sehr frühen Entwicklungsstadien unerlässlich ist. Domino gehört ebenfalls zu dem Material, das von der Mutter in die Eizelle eingebracht wird. Es platziert ein Protein namens Histonvariante H2A.Z auf dem Chromatin. „Unsere Daten zeigen, dass das von Domino aufgebrachte H2A.Z für die Transkriptionsaktivierung von zahlreichen Genen zu Beginn der zygotischen Genomaktivierung erforderlich ist. Umgekehrt, ohne Domino, ist H2A.Z auf dem Chromatin vermindert, und die Transkription ist stark reduziert, was zu einer hohen Sterblichkeit des Embryos führt,“ sagt Dafne Ibarra Morales.
Interessanterweise handelt es sich bei den meisten betroffenen Genen um sogenannte „Haushaltsgene“ (engl. „housekeeping gene“), die für die Aufrechterhaltung grundlegender zellulärer Funktionen wie etwa den Stoffwechsel erforderlich sind. Haushaltsgene werden unter normalen Bedingungen in allen Zellen eines Organismus exprimiert, unabhängig von Gewebetyp, Entwicklungsstadium oder Zellzykluszustand. Entsprechend zeigen die Ergebnisse den Forscherinnen und Forscher aus Freiburg, dass die Histonvariante H2A.Z in der Fliege ein wichtiger Regulator der Genaktivierung und Transkription während der ZGA ist und zudem entscheidend ist, um die richtige Chromatinumgebung für eine korrekte Entwicklung des Embryos zu schaffen.
Die Histonvariante H2A.Z findet sich jedoch nicht nur in Fruchtfliege, sondern ist auch in ganz unterschiedlichen Organismen wie Hefebakterien bis hin zu Säugetieren nachgewiesen. Angesichts dieser evolutionären Konservierung des Moleküls und der Tatsache, dass im Grunde sehr ähnliche Mechanismen der Genomaktivierung auch bei allen anderen Tieren vorkommen, spekuliert das Freiburger Team, dass Histonvarianten ähnliche Funktionen auch während der Embryogenese von Säugetieren haben könnten. „Zukünftige Studien zu dieser oder anderen Histonvarianten könnten ein besseres Verständnis dieser wichtigen und komplexen Prozesse am Lebensanfang ermöglichen, durch die Chromatinzustände und Transkriptionsfaktoren die Aktivierung des zygotischen Genoms nicht nur in Fliegen, sondern auch in anderen Tieren orchestrieren,“ sagt Nicola Iovino.
Max-Planck-Institut für Immunbiologie und Epigenetik
Originalpublikation:
Ibarra-Morales, D., Rauer, M., Quarato, P. et al. Histone variant H2A.Z regulates zygotic genome activation. Nat Commun12, 7002 (2021). doi.org/10.1038/s41467-021-27125-7