Spermienzellen unterscheiden sich in Aufbau und Funktion grundlegend von allen anderen Zelltypen. Letztlich besteht ihre einzige Aufgabe darin, die Eizelle aufzufinden und mit ihr zu verschmelzen. Ihre volle Aktivität erlangen Spermien erst in der sogenannten Kapazitation, das heißt bei der Reifung der Samenzellen. In einem der letzten Schritte dieses biochemischen Prozesses muss die Beweglichkeit der Spermien erhöht werden. Sind sie nicht oder lediglich in eingeschränktem Maße in der Lage, sich eigenständig zu bewegen, folgt daraus in der Regel eine verringerte Fruchtbarkeit oder vollständige Unfruchtbarkeit. Die Samenzellen können dann die Eizelle nicht erreichen und befruchten.
Innerhalb dieses finalen Reifungsprozesses kommt speziellen Proteinen, die sich in der Hülle des Spermiums befinden, eine besondere Bedeutung zu. Es handelt sich dabei um Membrantransporter. Sie sind dafür verantwortlich, zum Beispiel Nährstoffe in die Zelle hinein oder aus der Zelle heraus zu transportieren. „Bei Spermien hat der Transport von bestimmten Ionen in die Zelle hinein eine Erhöhung der Eigenbeweglichkeit zur Folge. Daher sind die für den Transport verantwortlichen Proteine direkt verbunden mit der Fertilität eines Spermiums und damit mit der Fruchtbarkeit eines männlichen Lebewesens“, betont Prof. Paulino. Ihre Forschungsgruppe beschäftigt sich am BZH mit Membrantransportern von Seeigeln, einem Modellsystem für die Forschung an Spermien.
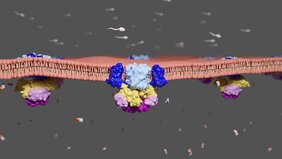
Mithilfe der Kryo-Elektronenmikroskopie konnten die Wissenschaftler nun den Aufbau eines wichtigen Membrantransporters für Spermien auf molekularer Ebene entschlüsseln. Sie haben dabei unter anderem herausgefunden, wie dessen funktionelle Einheiten aussehen, wie diese zusammenhängen und wie sie miteinander interagieren. „Wir haben beobachtet, dass das entscheidende Protein wie ein Legospielzeug aus verschiedenen Baueinheiten aufgebaut ist. Diese Bauteile sind im Grunde von anderen Proteinen bekannt, wurden allerdings noch nie zusammenhängend beobachtet. Mithilfe dieser Informationen konnten wir zum ersten Mal den Mechanismus dieses Transporters entschlüsseln“, erläutert Dr. Valeria Kalienkova von der Universität Bergen (Norwegen), die zuvor der Forschungsgruppe von Prof. Paulino angehört hat.
Nach den Worten von Dr. Martin Peter, Mitglied im Team von Prof. Paulino, sind diese neuen Erkenntnisse hilfreich, um in einem nächsten Schritt potentielle Substanzen zu entwickeln, die diesen Mechanismus beeinflussen. Damit ließen sich die Funktionen der Proteine möglicherweise aktivieren oder auch deaktivieren. Inwieweit sich diese Erkenntnisse auch auf den Mechanismus von humanen Spermien übertragen lassen, bedarf weiterer Forschung. Auf lange Sicht bergen sie das Potential, neue Wege bei der Behandlung von Unfruchtbarkeit oder umgekehrt bei der absichtlichen Verhinderung einer Befruchtung der Eizelle durch Spermien zu eröffnen.
Universität Heidelberg
Originalpublikation:
Kalienkova, V., Peter, M.F., Rheinberger, J. et al. Structures of a sperm-specific solute carrier gated by voltage and cAMP. Nature (2023). https://doi.org/10.1038/s41586-023-06629-w