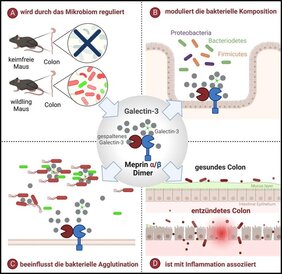
„Wir konnten erstmals zeigen, dass ein Komplex der Enzyme Meprin α und Meprin β lokalisiert auf den Darmzellen durch Umsetzung des Substrates Galektin-3 die Zusammensetzung des Mikrobioms beeinflusst“, erklärt Erstautorin Cynthia Bülck, Doktorandin am Biochemischen Institut der CAU. „Dieser Enzymkomplex wird in seiner Aktivität wiederum durch das Mikrobiom direkt beeinflusst“, ergänzt Professor Christoph Becker-Pauly, Mitglied des Exzellenzclusters „Precision Medicine in Chronic Inflammation“ (PMI) und Leiter der Arbeitsgruppe Proteolytische Netzwerke. „Das heißt, das Mikrobiom beeinflusst Wirtsproteine, die wiederum das Mikrobiom beeinflussen.“ Dieses Wechselspiel der Regulation des Enzymkomplexes haben die Forschenden in Mausmodellen mit unterschiedlicher Bakterienbesiedlung untersucht.
Enzymatische Spaltung beeinflusst Bindung an Bakterien
Im Zentrum der Forschung standen die proteinspaltenden Enzyme Meprin α und Meprin β, die im gesunden Darm produziert werden und bei chronisch-entzündlichen Darmerkrankungen (CED) deutlich vermindert sind. „Wir wollten einerseits die Funktion der Meprine im Dünn- und Dickdarm aufklären und andererseits verstehen, wie die Zusammensetzung der Bakterien im Darm grundlegend reguliert wird“, sagt Bülck. Die Proteasen kommen im gesamten Darm vor, sind aber keine typischen Verdauungsenzyme. „Bereits in früheren Studien konnten wir zeigen, dass diese Enzyme für die ständige Ablösung und Erneuerung der Darmepithel-schützenden Schleimschicht verantwortlich sind“, so Becker-Pauly. Um die weiteren Funktionen der Meprine aufzuklären, die im Dickdarm als Meprin α/β-Komplex vorkommen, haben die Forschenden zunächst mittels eines Massenspektrometrie-Verfahrens nach Substraten gesucht, die von diesem Enzymkomplex umgesetzt werden. Becker-Pauly: „Wir haben Galektin-3 als wichtiges Substrat im Dickdarm identifiziert.“
Galektin-3 wird permanent in den Darmzotten produziert. Es befindet sich in den Zellen aber auch außerhalb der Zelle in der Schleimschicht und kann dort mit Bakterien interagieren, diese zum Beispiel verklumpen (agglutinieren). Die proteolytische Spaltung von Galektin-3 durch Meprin α/β führte zu veränderten Eigenschaften der Bakterienbindung und gleichzeitig verändert sich die enzymatische Verarbeitung in Abhängigkeit von der bakteriellen Zusammensetzung. „Das heißt, je nachdem welche und wie viele Bakterien vorhanden sind, hat auch einen Einfluss darauf wie viel Galektin-3 prozessiert und exprimiert wird“, verdeutlicht Bülck. „Der Wirt reagiert über die Spaltung von Galektin-3 auf das Mikrobiom, welches dann wieder anders moduliert wird.“ In der Arbeit konnte außerdem gezeigt werden, dass die enzymatische Spaltung von Galektin-3 zu einer starken Agglutination (Verklumpung) und Eliminierung (Ausscheidung) des Krankheitserregers Pseudomonas aeruginosa führt, einem Keim, der etwa 10 Prozent aller Krankenhausinfektionen in Deutschland verursacht.
Schlüsselrolle bei der Homöostase des Mikrobioms
„Das Verständnis über die physiologische Rolle dieses Enzymkomplexes im Darm könnte neue Einblicke in die Entstehung von Krankheiten liefern sowie neue Wege zur Vorbeugung und Behandlung von Darmerkrankungen aufzeigen“, betont Becker-Pauly. Bei chronisch-entzündlichen Darmerkrankungen liege nicht nur der Enzymkomplex vermindert vor, auch vom Substrat, also Galektin-3, sei weniger vorhanden. „Dadurch wird möglicherweise das Darmmikrobiom aus dem Gleichgewicht gebracht, so dass pathogene Keime sich leichter ausbreiten können“, vermutet der Kieler Biochemiker. Diese Konstellation sei sicher nicht ausschlaggebend für die Entstehung chronisch-entzündliche Darmerkrankungen, da hier viele Faktoren eine Rolle spielten, aber es sollte bedacht werden.
In weiteren Forschungen wird es jetzt darum gehen, die Mechanismen detailliert aufzuklären, die zur Verklumpung bestimmter Bakterienarten führen. Außerdem wurden weitere immunmodulatorische Substrate des Meprin α/β-Komplexes identifiziert, deren Funktion nun analysiert werden sollen.
Albrechts-Universität zu Kiel, Exzellenzcluster Präzisionsmedizin für chronische Entzündungserkrankungen
Originalpublikation:
Bülck C, et al. Proteolytic processing of galectin-3 by meprin metalloproteases is crucial for host microbiome homeostasis. Science Advances. First published: 31 March 2023 https://doi.org/10.1126/sciadv.adf4055