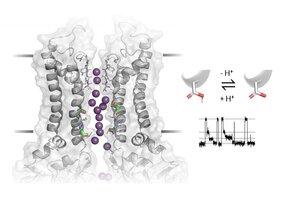
Eine aktuelle Studie unter Beteiligung von Forschenden der Universität Wien liefert eine schlüssige Erklärung für den komplexen Vorgang, der dem Öffnen und Schließen von Ionenkanälen mit mehreren Untereinheiten zugrunde liegt. Überraschend dabei war die Entdeckung eines engen Zusammenhangs mit der Leitfähigkeit des Kanals. Dafür entwickelte das internationale Forschungsteam ein smartes Modellsystem, mit dem das "Gating" – der Wechsel zwischen offenem und geschlossenem Zustand dieser Kanäle – im Detail analysiert werden konnte. Die Ergebnisse der vom österreichischen Wissenschaftsfonds FWF geförderten Arbeit waren eindeutig: die Bewegung einzelner Untereinheiten führt zu unterschiedlichen Leitfähigkeiten.
Zellen stehen mit ihrer Umgebung über Ionenkanäle in Verbindung, die als röhrenförmig angeordnete Proteinkomplexe in die Zellmembran eingebettet und selektiv sind – d.h. nur bestimmte Ionensorten durchlassen. Dementsprechend sind Kaliumkanäle Membranproteine, deren Poren nur für Kalium+-Ionen permeabel sind. Eine Untergruppe dieser Kanäle, zu denen die in der Studie analysierten Kir2-Kanäle gehören, bilden die einwärts gleichrichtenden K+-Kanäle ("inwardly rectifying"). Aus mehreren gleichen Untereinheiten bestehend, sind sie funktionell für die Stabilisierung des Ruhemembranpotentials der Zellen zuständig und so an der Steuerung zahlreicher physiologischer Prozesse beteiligt. Weil solche Ionenkanäle in der pharmazeutischen Forschung als wirkungsvolle Ansatzpunkte für verschiedene Arzneistoffe identifiziert wurden, ist ein detailliertes Verständnis ihrer Funktionsweise besonders wichtig – und das Forschungsteam der Universität Wien und der Washington University in St. Louis konnte dazu einen wichtigen Beitrag leisten.
Intelligentes Studiendesign & innovative Methoden
Um im Detail zu verstehen, wie sich Kir2-Kanäle nun tatsächlich öffnen und schließen, entwickelten die Wissenschafter*innen ein Modellsystem, mit dem sie das "Gating" einzelner Untereinheiten schrittweise analysierbar und alle Änderungen in der Leitfähigkeit der Kanäle messbar machten. Forscherin Eva-Maria Plessl vom Department für Pharmazeutische Wissenschaften der Universität Wien erklärt: "Dafür haben wir in die Untereinheiten des Kanals experimentell saure Aminosäurereste so eingebaut, dass diese in der Kanalpore ganz in der Nähe der Öffnung saßen. Dadurch entdeckten wir neue Leitfähigkeits-Zustände, sogenannte "sub-conductance states". Es zeigte sich, dass diese durch die Bewegung einzelner Untereinheiten ausgelöst wurden und vom pH-Wert im Zytoplasma der Zellen abhängig sind.
Sauer macht...weniger leitfähig
Die Beobachtung, dass die "sub-conductance states" durch Änderungen des pH-Werts beeinflusst werden konnten, legte eine wichtige Schlussfolgerung nahe. Dazu Wissenschafterin Anna Weinzinger, ebenfalls am Department für Pharmazeutische Wissenschaften der Universität Wien aktiv: "Wahrscheinlich wird dieses Phänomen durch Protonen-Aufnahme oder -Abgabe einzelner saurer Reste in der Nähe der Pore ausgelöst." Tatsächlich unterstützten weiterführende computergestützte Simulationen ("Molekulardynamiksimulationen") mit unterschiedlichen Protonierungszuständen saurer Reste diese Annahme. "Wir sind stolz darauf, dass wir mit unserer Arbeit einen wichtigen Beitrag zur Aufklärung des ,Gating‘-Vorgangs bei Kir2-Kanälen leisten konnten. Aufgrund langjähriger Forschung ging man bisher davon aus, dass ,Gating‘ und Leitfähigkeit separate Prozesse in Ionenkanälen darstellen. Besonders freut uns, dass es uns gelang, einen bisher nicht bekannten engen Zusammenhang zwischen ,Gating‘ und Leitfähigkeit nachzuweisen", meint Anna Weinzinger.
Universität Wien
Originalpublikation:
Subunit gating resulting from individual protonation events in Kir2 channels. Maksaev, Grigory, Bründl-Jirout Michael, Stary-Weinzinger Anna, Zangerl-Plessl Eva-Maria, Lee Sun-Joo, Nichols Colin. Nature Communications, DOI: 10.1038/s41467-023-40058-7, https://doi.org/10.1038/s41467-023-40058-7