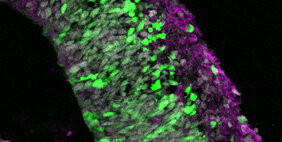
Diese wenige Millimeter großen, dreidimensionalen Zellstrukturen spiegeln verschiedene Stadien der Gehirnentwicklung wider und können genetisch verändert werden. Solche Modifikationen sind allerdings meist sehr aufwendig, langwierig und kostspielig. Forschenden am Deutschen Primatenzentrum (DPZ) – Leibniz-Institut für Primatenforschung in Göttingen ist es nun gelungen, Hirnorganoide schnell und effektiv genetisch zu manipulieren. Das Verfahren benötigt nur wenige Tage statt wie sonst mehrere Monate und kann für Organoide verschiedener Primatenarten eingesetzt werden. Die Hirnorganoide ermöglichen so vergleichende Studien zur Funktion von Genen in frühen Phasen der Gehirnentwicklung bei Primaten und helfen, neurologische Krankheitsbilder besser zu verstehen.
Die Hirnorganoide werden im Labor aus sogenannten induzierten pluripotenten Stammzellen gezüchtet. Diese Zellen werden meist aus Haut- oder Blutzellen gewonnen, die zuvor „reprogrammiert“ werden. Das heißt, sie werden so verändert, dass sie sich zu Stammzellen zurückentwickeln und sich danach in jeden anderen Zelltyp differenzieren können, wie zum Beispiel Nervenzellen.
„Uns interessieren vor allem die genetischen Faktoren, die der Gehirnentwicklung in Primaten zugrunde liegen“, erklärt Michael Heide, Leiter der Nachwuchsgruppe Gehirnentwicklung und -evolution am DPZ und Autor der Studie. „Die Hirnorganoide erlauben uns, diese Prozesse in der Petrischale nachzuvollziehen. Dafür müssen wir sie jedoch genetisch verändern.“
Bisher waren diese Verfahren teilweise sehr arbeitsintensiv und dauerten mehrere Monate. Das Team von Forschenden um Michael Heide hat nun eine Methode entwickelt, die es erlaubt, Hirnorganoide schnell und kosteneffizient genetisch zu manipulieren.
„Wir nutzen für unsere Methode die Mikroinjektion und Elektroporation“, erklärt Heide. „Dabei wird genetisches Material mit einer sehr dünnen Kanüle in die Organoide injiziert und mit Hilfe eines kleinen elektrischen Impulses in die Zellen eingebracht. Das dauert nur wenige Minuten und die Hirnorganoide sind nach ein paar Tagen analysierbar.“
Für das Einbringen des genetischen Materials werden Plasmide verwendet. Das sind ringförmige DNA-Stücke, die das Gen von Interesse enthalten. In der Machbarkeitsstudie verwendeten die Forschenden dafür das Gen für das grün fluoreszierende Protein (GFP). Erfolgreich veränderte Zellen in den Hirnorganoiden leuchten so unter Fluoreszenzlicht grün.
„Die Methode eignet sich gleichermaßen für Hirnorganoide aus Menschen, Schimpansen, Rhesusmakaken und Weißbüschelaffen“, fasst Heide zusammen. „Das ermöglicht uns vergleichende Studien zur physiologischen und evolutionären Gehirnentwicklung bei Primaten durchzuführen und ist außerdem ein effektives Werkzeug, um genetisch bedingte neurologische Fehlbildungen zu simulieren, ohne dafür Affen in Tierversuchen einsetzen zu müssen.“
DPZ
Originalpublikation:
Tynianskaia L, Eşiyok N, Huttner WB, Heide M (2023): Targeted microinjection and electroporation of primate cerebral organoids for genetic modification. Journal of Visualized Experiments (193), e65176, doi:10.3791/65176