Das Auslesen der Erbinformation gehört zu den wichtigsten Prozessen in Körperzellen. Unterlaufen bei der so genannten Gentranskription und der daraus folgenden Protein-Produktion Fehler, können Krebserkrankungen sowie Stoffwechsel- und Entwicklungsstörungen entstehen. Um neue Medikamente oder Therapien für solche Krankheiten zu entwickeln, ist also eine genaue Kenntnis der molekularen Abläufe im Zellinneren wichtig. Nun haben Forschende um Professor Christof Gebhardt vom Institut für Biophysik der Universität Ulm ein detailreiches Modell der Gentranskription erarbeitet. Das Modell, das auf Einblicken in spezielle Zelllinien mit einer hochsensitiven Mikroskopiertechnik beruht, wird im Fachjournal „Nucleic Acids Research“ vorgestellt.
Bei der Genregulation werden Abschnitte des Erbguts (DNA) ein- und ausgeschaltet. Diese Steuerung der Genaktivität kann über Gesundheit und Krankheit eines Menschen entscheiden oder schlichtweg über sein Aussehen. Im Zuge der so genannten Proteinbiosynthese werden solche Erbgutabschnitte in Boten-RNA (mRNA) umgeschrieben und schließlich in Proteine umgesetzt – das sind wichtige Bausteine des Körpers. Dieser Übertragungsvorgang von DNA in RNA heißt Transkription. Zu welcher Zeit und in welcher Menge das vom Gen codierte Protein gebildet wird, bestimmt dabei ein spezieller Erbgutabschnitt, genannt Promotor, an den ein Transkriptionsfaktor andockt und das Startsignal gibt. Wie sich das Binden und Loslassen dieses Transkriptionsfaktors an den Promotor auf die Gentranskription auswirkt, war die Ausgangsfrage der Ulmer Biophysiker. „Obwohl wichtige Zellprozesse von bestimmten Proteinmengen abhängen, haben Genregulation und somit auch Transkription eine starke zufällige Komponente: Ist das Gen aktiviert, werden kurzfristig viele RNA-Moleküle hergestellt und pulsartig freigesetzt. Ist es ausgeschaltet, findet hingegen keine RNA-Produktion statt. Dadurch kann sich die Proteinmenge in genetisch gleichen Zellen stark unterscheiden“, erklärt Professor Christof Gebhardt. Die zugrundeliegenden Mechanismen waren bis dato noch nicht ausreichend bekannt.
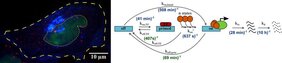
Um ein tieferes Verständnis der Gentranskription und insbesondere ihres zeitlichen Ablaufs zu erlangen, haben die Ulmer Biophysiker Schlüsselkomponenten analysiert –nämlich die Such- und die Bindezeit des Transkriptionsfaktors an den Promotor. Hierfür entwickelten sie in jahrelanger Arbeit spezielle Zelllinien, die ein Reportergen, einen modifizierten Transkriptionsfaktor und Hilfsproteine für die Konzentrationsregulation sowie RNA-Visualisierung enthalten. In diesen Zellen konnte die Such- und Bindezeit des Transkriptionsfaktors gezielt variiert und die daraus resultierende Transkription des Reportergens nachvollzogen werden. Die Forschenden nutzten ein spezielles, selbst gebautes Mikroskop mit hoher Sensitivität, um einzelne Moleküle in den lebenden Zellen sichtbar zu machen. Die Variation der Bindezeit wurde mittels Einzelmolekül-Fluoreszenzmikroskopie in lebenden Zellen gemessen. „Um den Ablauf der Gentranskription nachzuvollziehen, benötigten wir zudem einen Nachweis über die produzierte RNA: Dies erfolgte über Einzelmolekülbildgebung in chemisch fixierten Zellen, wodurch wir die Transkriptionspulse zählen konnten. Alternativ wurde die RNA direkt in den lebenden Zellen sichtbar gemacht“, erläutert Erstautor Achim Popp, Doktorand am Institut für Biophysik. Daneben war Johannes Hettich als Koautor an der Studie beteiligt.
Im Ergebnis beeinflussen sowohl die Binde- als auch die Suchzeit des Transkriptionsfaktors die Aktivierung eines Gens: Je länger ein Transkriptionsfaktor am Promotor bindet und je schneller er die Bindestelle findet, desto häufiger wird das Gen angeschaltet. „Insgesamt hat die Bindezeit jedoch einen noch größeren regulatorischen Einfluss auf die Gentranskription als die Suchzeit“, konkretisiert Gebhardt.
Diese erstmals nachgewiesene regulatorische Asymmetrie hat es den Forschenden ermöglicht, ein neues Modell der Gentranskription aufzustellen: Dabei schaltet das Binden eines Transkriptionsfaktors das Gen nicht sofort an – es müssen weitere Schritte erfolgen. Zu jedem dieser Übergänge können die Forschenden nun Wahrscheinlichkeiten pro Zeiteinheit angeben, so genannte kinetische Raten.
Sie zeigten zum Beispiel, dass ein einzelner Transkriptionsfaktor über ein Jahr braucht, um eine bestimmte Bindestelle am Promotor zu finden. Da es in jeder Zelle tausende Transkriptionsfaktoren einer Sorte gibt, reduziert sich die durchschnittliche Suchzeit bis zum Andocken auf ungefähr 40 Minuten. Das neue Modell ermöglicht also ein besseres Verständnis der molekularen Mechanismen – und insbesondere der zeitlichen Aspekte – der Gentranskription. Darauf basierend könnten sich eines Tages sogar neue therapeutische Ansätze bei Stoffwechselerkrankungen oder Krebs ergeben.
Universität Ulm
Originalpublikation:
Achim P. Popp, Johannes Hettich and J. Christof M. Gebhardt: Altering transcription factor binding reveals comprehensive transcriptional kinetics of a basic gene. Nucleic Acids Research, 2021