Ein Forschungsteam unter der Leitung von Kimberly Hartl, Doktorandin am Berliner Institut für Medizinische Systembiologie des Max Delbrück Center (MDC-BIMSB) und der Charité – Universitätsmedizin, hat neue Erkenntnisse über die Rolle des Tumorsuppressor-Gens p53 bei der Pathogenese der Colitis ulcerosa (CU) gewonnen. Von dieser entzündlichen Darmerkrankung sind etwa fünf Millionen Menschen weltweit betroffen, sie ist mit einem erhöhten Risiko für Darmkrebs verbunden. Die Ergebnisse des Teams weisen nun auf ein neues Wirkstoffziel hin, um das Fortschreiten der Krankheit zu verhindern. Die Studie wurde in der Fachzeitschrift „Science Advances“ veröffentlicht.
„Bei Patientinnen und Patienten mit Colitis ulcerosa, die ein hohes Krebsrisiko haben, könnten wir potenziell die veränderten Zellen gezielt ansprechen und sie frühzeitig beseitigen, bevor ein Krebs entsteht“, sagt Professor Michael Sigal, Leiter der Arbeitsgruppe „Gastrointestinale Barriere, Regeneration und Karzinogenese“ am MDC-BIMSB, Oberarzt sowie Leiter der Luminalen Gastroenterologie an der Charité und Letztautor der Studie.
Das Gen p53 spielt eine Schlüsselrolle
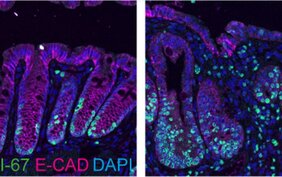
Colitis ulcerosa betrifft den Dickdarm, insbesondere die „Krypten“. Diese röhrenförmigen Drüsen im Epithelgewebe kleiden den Darm aus. In den Krypten finden sich Stammzellen und andere Zelltypen, die die Gesundheit und normale Funktion des Dickdarms aufrechterhalten, wie zum Beispiel die Aufnahme von Nährstoffen oder die Sekretion von Schleim.
Wenn der Dickdarm verletzt ist, gehen die Epithelzellen der Krypten in einen „Reparaturmodus“ über. Sie vermehren sich dann schnell, um die Verletzung zu beheben. Bei Patient*innen mit CU und CU-bedingten Darmkrebsarten bleiben diese Zellen allerdings im Reparaturmodus stecken; Wissenschaftler*innen bezeichnen das als einen „regenerativen Zellzustand“. Das Ergebnis ist ein Mangel an reifen Zellen. Der Dickdarm hat somit Schwierigkeiten, normal zu funktionieren und die Stammzellen vermehren sich noch stärker. Eine toxische Rückkopplungsschleife beginnt.
Dieser defekte Reparaturmechanismus hat mit einem nicht funktionierenden p53-Gen zu tun, fand Hartl in der aktuellen Studie heraus. Es spielt eine Schlüsselrolle bei der Regulierung des Zellzyklus und der DNA-Reparatur. „Ohne p53 bleiben die Zellen in einem proliferativen Zustand“, sagt Sigal.
Bisherige Teste wie zum Beispiel Koloskopien, die Krebsvorstufen bei CU-Patienten erkennen sollen, können sichtbare Läsionen identifizieren. Diese Läsionen seien manchmal schwer zu entfernen, sagt Sigal. Die jetzt vorliegende Studie könnte ein erster Schritt sein, um molekulare Werkzeuge für einen weniger invasiven diagnostischen Test zu entwickeln. Das würde es Ärzt*innen ermöglichen, die veränderten Zellen deutlich früher zu identifizieren – bevor die Veränderungen sichtbar sind, fügt er hinzu.
Wenn Regeneration außer Kontrolle gerät
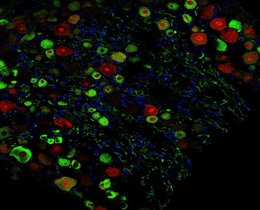
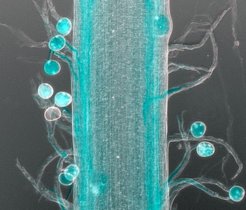
Um den Reparaturmechanismus zu analysieren, entwickelten die Forscher*innen aus Mausstammzellen ein Dickdarm-Organoid – ein dreidimensionales Mini-Organ – das des Dickdarms. Gemeinsam mit Spezialist*innen für DNA- und RNA-Sequenzierung sowie der Technologieplattform für Proteomik und Metabolomik am Max Delbrück Center fanden sie heraus, dass Stammzellen, denen p53 fehlte, im regenerativen Zustand bleiben. Daher verstoffwechselten sie Glukose schneller durch den Prozess der Glykolyse. Im Gegensatz dazu verringerte aktives p53 den Glukosestoffwechsel und signalisierte den Zellen, in einen gesunden Zustand zurückzukehren.
Anschließend behandelten die Wissenschaftler*innen die Organoide mit Wirkstoffen, die die Glykolyse stören. So konnten sie testen, ob sie diese sich stark teilenden Zellen gezielt beeinflussen könnten. Zellen, denen das Gen p53 fehlte, sprachen tatsächlich besser auf diese Behandlung an als normale Zellen. „Mithilfe der Organoide können wir sehr spezifische Wirkstoffe identifizieren, die auf Stoffwechselwege abzielen. Das gibt uns Hinweise auf potenzielle neue Therapeutika, die mutierte Zellen selektiv angreifen“, fügt sie hinzu.
Der nächste Schritt ist, diese Erkenntnisse auf den Menschen zu übertragen. Das Team erforscht außerdem nun den Reparaturprozess im Detail. Sie wollen einfachere Methoden entwickeln, um Zellen mit defekten p53-Genen im Dickdarmgewebe zu identifizieren.
„Sobald wir eine einfache Methode haben, um genau diese Zellen im Dickdarmgewebe zu identifizieren, könnten wir mit klinischen Studien beginnen, um sie selektiv zu beseitigen und dann analysieren, ob dies mit einem geringeren Krebsrisiko verbunden ist“, sagt Sigal.
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft
Originalpublikation:
Kimberly Hartl, Safak Bayram, Alexandra Wetzel et al. (2024): „P53 terminates the regenerative fetal-like state after colitis-associated injury.” Science Advances. DOI: 10.1126/sciadv.adp8783, https://www.science.org/doi/10.1126/sciadv.adp8783