Bei Hämophilie A-Kranken ist ein Protein defekt, das für die Blutgerinnung wichtig ist: der Faktor VIII. Zur Behandlung erhalten die meisten Betroffenen daher alle paar Tage eine intravenöse Injektion mit dem funktionsfähigen Gerinnungsfaktor. Doch häufig und besonders zu Beginn der Behandlung erkennt das Immunsystem den gespritzten Wirkstoff als körperfremd und attackiert ihn. Dies ist die schwerste Komplikation der Hämophilie-Behandlung, weil Faktor VIII dann nicht mehr wirken kann.
In diesen Fällen hilft oft eine Immuntoleranz-Therapie, die bereits vor mehr als 40 Jahren ebenfalls am Universitätsklinikum Bonn (UKB) entwickelt wurde. Dabei wird den Bluterkranken über mehrere Monate regelmäßig eine hohe Dosis Faktor VIII gespritzt. Das Immunsystem gewöhnt sich dadurch an das injizierte Protein und toleriert es. „Allerdings klappt das nicht immer“, erklärt Prof. Dr. Johannes Oldenburg, Direktor des Instituts für Experimentelle Hämatologie und Transfusionsmedizin des UKB. „Bei etwa 30 Prozent der Patienten führt die Gewöhnung nicht zum Erfolg. Ihre körpereigene Abwehr attackiert also weiterhin das Faktor VIII-Protein und vernichtet es, so dass Faktor VIII nicht zur Behandlung eingesetzt werden kann. Wir wollten wissen, woran das liegt.“
Dazu hat sich das Team zwei Zelltypen des Immunsystems angesehen, die B-Zellen und die regulatorischen T-Zellen. B-Zellen erkennen fremde Moleküle im Körper und produzieren dagegen Antikörper, die die Funktion des Moleküls abschalten. Für den Faktor VIII bedeutet dies, dass er bei der Hämophilie-Behandlung nicht mehr wirksam ist.
Bremse im Immunsystem
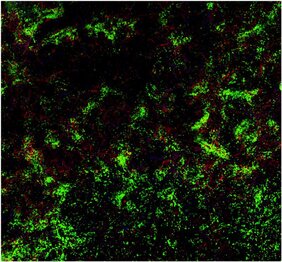
Regulatorische T-Zellen verhindern, dass eine Immunreaktion zu stark ausfällt oder zu lange anhält. Die Forschenden haben unter ihnen nun eine neue Art gefunden, die speziell gegen bestimmte B-Zellen vorgehen kann und nicht nur unspezifisch gegen alle Immunantworten. „Wir konnten zeigen, dass die Immuntoleranz-Therapie zur Bildung regulatorischer T-Zellen führt, die ausschließlich B-Zellen gegen Faktor VIII zum Selbstmord veranlassen“, sagt Dr. Janine Becker-Gotot vom Institut für Molekulare Medizin und Experimentelle Immunologie (IMMEI) des UKB. „Diese T-Zellen verfügen über einen Sensor, mit dem sie die entsprechenden B-Zellen erkennen und sich an sie heften. Zusätzlich haben sie die Fähigkeit, den Selbstzerstör-Knopf auf der Oberfläche der B-Zellen zu drücken.“
Dieser Knopf ist ein Molekül namens PD-1. Durch seine Aktivierung startet er in der B-Zelle ein Programm, das zu ihrem Tod führt. Jede aktive B-Zelle verfügt über diesen Knopf. „Wir konnten in unseren Experimenten erstmals regulatorische T-Zellen nachweisen, die diesen Selbstzerstör-Knopf nur bei ganz bestimmten B-Zellen aktivieren können, um ungewollte Immunantworten gezielt zu verhindern“, erklärt der Direktor des IMMEI Prof. Dr. Christian Kurts.
Je mehr PD-1-Knöpfe die B-Zellen gegen Faktor VIII auf ihrer Oberfläche tragen, desto leichter lassen sie sich durch die Immuntoleranz-Therapie in den Selbstmord treiben. „Die PD-1-Menge ist von Person zu Person verschieden“, erklärt Becker-Gotot. „Ist sie von vornherein sehr gering, ist die Wahrscheinlichkeit groß, dass viele Hemmkörper-produzierende B-Zellen überleben und den injizierten Faktor VIII weiterhin neutralisieren.“
Test soll zeigen, bei wem eine Immuntoleranz-Therapie sinnvoll ist
Interessanterweise bilden B-Zellen auch mehr PD-1, sobald sie mit regulatorischen T-Zellen in Kontakt kommen. „Wir können inzwischen testen, wie stark diese Reaktion ausfällt“, sagt die Wissenschaftlerin. „Wenn die PD-1-Menge kurz nach Start der Immuntoleranz-Therapie hoch geht und dann auch oben bleibt, ist das ein klares Zeichen dafür, dass sie Erfolg haben wird.“ Das Team entwickelt gerade einen Bluttest, mit dem sich schon während der langwierigen Behandlung erkennen lässt, ob bei den Betroffenen die Immuntoleranz-Therapie anschlägt oder nicht.
„Unsere Erkenntnisse haben großen grundlagenwissenschaftlichen Wert“, erklärt Prof. Kurts, der an der Universität Bonn dem Transdisziplinären Forschungsbereich „Life & Health“ angehört sowie - wie auch Dr. Becker-Gotot und Prof. Oldenburg - Mitglied im Exzellenzcluster ImmunoSensation ist. „Und zwar nicht nur für die Hämophilie, sondern auch für andere angeborene Erkrankungen, bei denen fehlende Proteine therapeutisch ersetzt werden. Langfristig könnten sie sich auch zur Entwicklung neuer Behandlungsmethoden nutzen lassen.“
Universitätsklinikum Bonn
Originalpublikation:
Janine Becker-Gotot, Mirjam Meissner, Vadim Kotov, Blanca Jurado-Mestre, Andrea Maione, Andreas Pannek, Thilo Albert, Chrystel Flores, Frank A. Schildberg, Paul A. Gleeson, Birgit M. Reipert, Johannes Oldenburg, and Christian Kurts: Immune tolerance against infused FVIII in hemophilia A is mediated by PD-L1+ regulatory T cells; The Journal of Clinical Investigation; DOI: 10.1172/JCI159925, www.jci.org/articles/view/159925