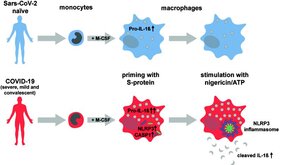
Die Arbeit der Kölner Forscher untersucht nun erstmals die Wirkung des Spikeproteins auf das angeborene Immunsystem, dessen Aktivität auch mit schweren Krankheitsverläufen assoziiert ist. Die Ergebnisse wurden nun im renommierten Wissenschaftsjournal „EMBO Molecular Medicine“ veröffentlicht.
Eine SARS-CoV-2 Infektion kann zur massiven Ausschüttung von entzündungsfördernden Signalstoffen, sogenannten Zytokinen führen, die bei einigen Patienten zu stärksten Organschädigungen führt und in einer Kettenreaktion weitere, aktivierte Abwehrzellen ins Gewebe lockt. Wie das Virus die Ausschüttung von Zytokinen triggert ist bisher nicht gut verstanden. Kölner Forscher konnten nun zeigen, dass menschliche Abwehrzellen (Makrophagen, auch Fresszellen genannt) durch das virale Spikeprotein massiv zur Produktion des entzündungsfördernden Signalstoffs Interleukin 1 angeregt werden. Allerdings gelang dies nur, wenn in den Versuchen die Makrophagen von COVID-19-Patienten untersucht wurden. Makrophagen von Menschen, die noch keinen Kontakt mit SARS-CoV-2 hatten, reagierten nicht mit der Ausschüttung von Interleukin 1.
„Diese selektive Immunantwort eines klassischen Signalwegs des angeborenen Immunsystems ist sehr ungewöhnlich und wurde so noch nicht beschrieben. Hier gibt es nun viele Ansatzpunkte um zu verstehen, warum einige Menschen mit einer überschießenden Reaktion des Immunsystems reagieren“ erklärt Priv. Doz. Dr. Jan Rybniker, Leiter des Forschungslabors der Infektiologie an der Uniklinik Köln und Letztautor der Studie. Der hier untersuchte Signalweg des Inflammasoms, der letztendlich zur Ausschüttung von Interleukin 1 führt, gilt auch als möglicher therapeutischer Ansatzpunkt für immunmodulatorische Therapien bei schweren COVID-19-Infektionen. Hierfür wurde in dieser Arbeit eine wissenschaftliche Grundlage identifiziert.
Interessanterweise waren die Makrophagen auch noch mehrere Wochen bis Monate nach einer SARS-CoV-2-Infektion durch das Spikeprotein sehr stark aktivierbar. „Da Makrophagen eine sehr kurze Lebensdauer von nur wenigen Tagen haben, spricht dies für Veränderungen der DNA von Makrophagen-Vorläuferzellen. Diese sogenannten epigenetischen Veränderungen konnten wir durch aufwändige Sequenzierversuche auch nachweisen“, berichtet Dr. Sebastian Theobald, Postdoktorand an der Uniklinik Köln und Erstautor der Studie. Diese tiefgreifenden Veränderungen von Makrophagen bis hin zum Erbgut der Zellen können nun für ein besseres Verständnis von Langzeitfolgen der COVID-19-Erkrankung genutzt werden. Die Sequenzierarbeiten wurden in enger Kooperation mit Prof. Peter Tessarz (Max-Planck-Instituts für die Biologie des Alterns) und Prof. Peter Nürnberg (Cologne Center for Genomics) durchgeführt.
„Da unsere Arbeiten auf der Immunantwort gegen das Spikeprotein basieren, können wir nun auch die Impfantwort gegen SARS-SoV-2 besser einordnen und verstehen, da fast alle derzeit verfügbaren Impfungen auf diesem Protein basieren“, berichtet Dr. Alexander Simonis, Assistenzarzt an der Uniklinik Köln und Zweitautor der Studie. „Für den Erfolg der verschiedenen Impfkonstrukte ist es sicher förderlich, dass das Spikeprotein zu einer starken Aktivierung des angeborenen Immunsystems führt“, ergänzt Rybniker.
Diese vielschichtigen und tiefgehenden Untersuchungen waren nur durch die Hilfe mehrerer Kooperationspartner möglich. An der Studie waren insgesamt acht Arbeitsgruppen der Universität zu Köln beteiligt. „Von großer Hilfe war für uns die Produktion des Spikeproteins durch die Arbeitsgruppe von Prof. Manuel Koch am Zentrum für Biochemie“, so Priv. Doz. Dr. Jan Rybniker. Finanziert wurde die Studie unter anderem von der Deutschen Forschungsgemeinschaft (DFG) und dem Deutschen Zentrum für Infektionsforschung (DZIF).
Zudem wurde die Studie maßgeblich durch die Immunologie-Plattform COVIM unterstützt, einem Verbundprojekt zur Bestimmung und Nutzung von SARS-CoV-2 Immunität. COVIM ist Teil des Netzwerks Universitätsmedizin (NUM). Das Netzwerk umfasst die gesamte deutsche Universitätsmedizin und fördert kooperative und strukturbildende Projekte, bei denen möglichst viele Universitätsklinika eingebunden sein sollen.
Uniklinik Köln
Originalpublikation:
Sebastian J Theobald et al.: Long-lived macrophage reprogramming drives spike protein-mediated inflammasome activation in COVID-19, EMBO Molecular Medicine, DOI: 10.15252/emmm.202114150